编者按:对于肿瘤治疗来说,化疗常常是“杀敌一千,自损八百”;抗体药物,能够精准地寻找肿瘤靶点,却也难以杀灭所有的残留病灶。试想,在抗体药物上安上化疗药物“弹头”,是否可以精准消灭癌细胞?基于此,有着“生物导弹”之称的抗体药物偶联物(Antibody-drug conjugates, ADC)横空出世了。为此,《肿瘤瞭望》特邀辽宁省肿瘤医院的孙涛教授来为我们谈一谈改变乳腺癌治疗的新进展及ADC药物用药经验分享。
《肿瘤瞭望》:乳腺癌在诊断和治疗方面不断进步,也取得了令人兴奋的进展,这些进展将会改善乳腺癌患者的生活。能否请您为我们谈一谈乳腺癌治疗的最新进展?
孙涛教授:早在百年前诺贝尔生理或医学奖得主Paul Ehrlich就提出了利用抗体靶向治疗癌症的“magic bullet“概念。近几年,随着抗体药物偶联物(ADC)技术的进步,目前已取得了阶段性成功。ADC的设计思路是将抗体与细胞毒药物进行偶联,既发挥了抗体高特异性,又发挥了细胞毒小分子的高毒性,利用抗体-抗原的高度靶向结合将药物输送至肿瘤部位,将细胞毒药物强大的细胞杀伤能力集中于肿瘤细胞,降低正常组织的毒副作用。
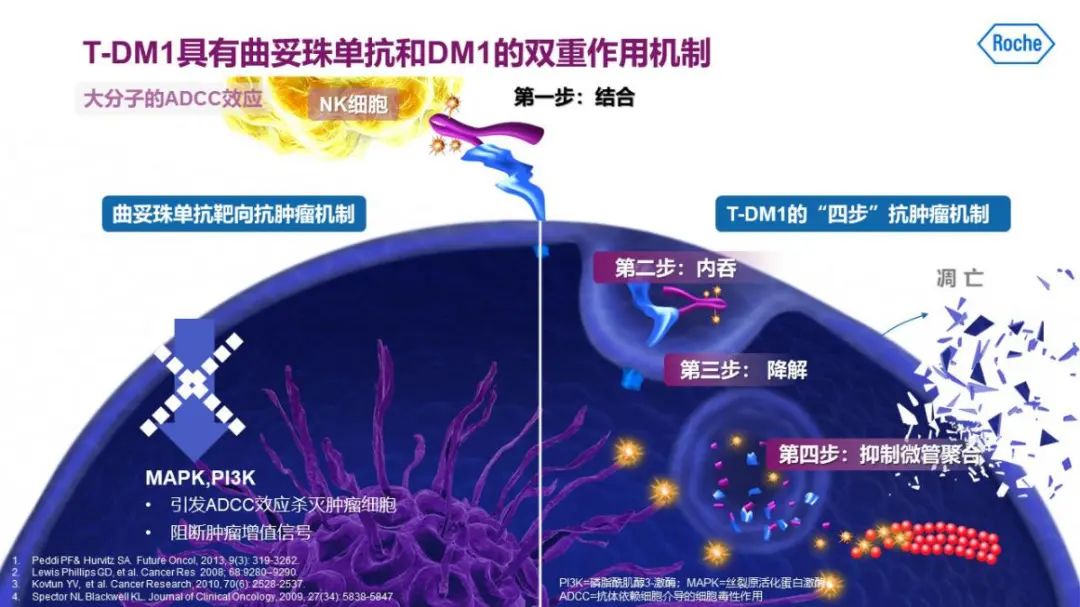
T-DM1是乳腺癌治疗中全球首个ADC药物,它有以下两个特点:首先,与曲妥珠单抗相比,T-DM1不仅可发挥曲妥珠单抗靶向抗肿瘤的作用,还可靶向发挥DM1抗微管作用,更加高效;其次,与曲妥珠单抗+化疗相比,T-DM1中曲妥珠单抗与高效强效抗微管药物DM1之间存在稳定的硫醚连接体,可降低化疗毒性。
当然,在乳腺癌治疗领域中还有一些其他新进展。近年来,CDK4/6抑制剂进一步改善了Luminal型转移性乳腺癌患者的内分泌治疗效果,MONALEESA-7、MONALEESA-3、MONARCH-2等三项研究的更新则进一步看到了CDK4/6抑制剂联合内分泌治疗,无论是在一线或二线治疗中均有OS获益优势,这将改变过去以单独内分泌治疗为主的治疗格局。而Young-PEARL和PEARL研究入组患者均为内分泌治疗耐药患者,尤其后者多数是经过多线治疗的AI耐药患者,因而得到了整体阴性结果,后线治疗中CDK4/6抑制剂与化疗之间的“角力”仍胜负未定。此外,对于HR+/HER2+或者携带PIK3CA突变的晚期患者,MonarcHER和SOLAR-1则分别提供了CDK4/6抑制剂联合抗HER2和PI3K抑制剂联合内分泌治疗的新选择。
《肿瘤瞭望》:对于HER2阳性早期乳腺癌的患者,新辅助治疗后non-pCR 成为新的治疗决策点,对于这部分患者后续的治疗策略您有怎样的看法?
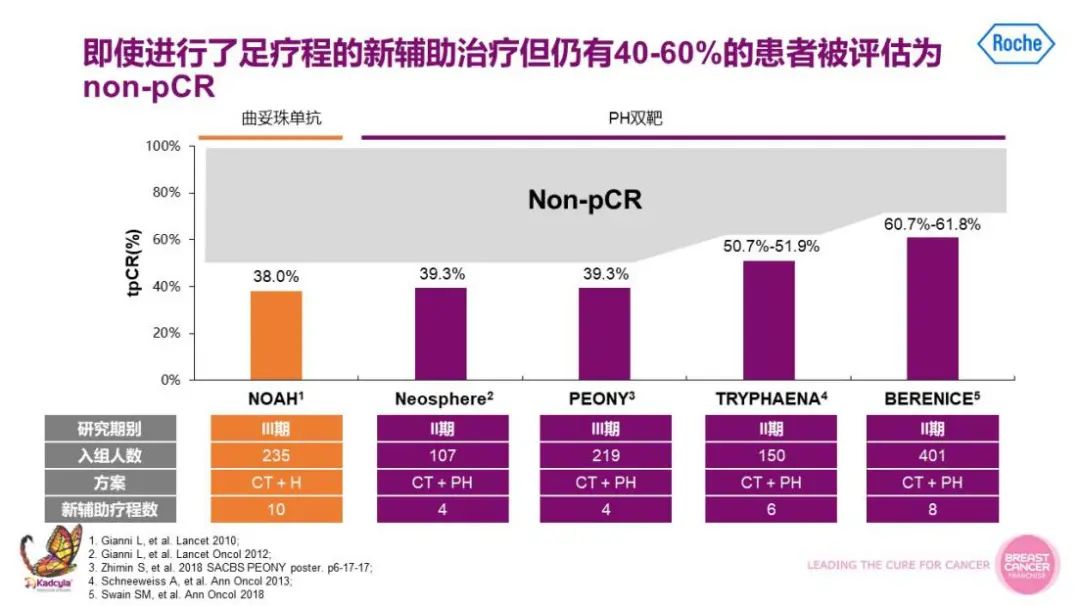
孙涛教授:对于肿瘤>2cm或淋巴结阳性的HER2阳性乳腺癌患者,应该首先考虑新辅助治疗,新辅助治疗不仅可以实现降期、保乳手术的目的,还可以提供药物数据,指导患者辅助治疗的药物选择,改善长期预后。新对于新辅助治疗而言,而即使有了PH双靶,乳腺癌患者抗HER2新辅助治疗后,仍有40%-60%的患者被评估为有残存病灶。这部分非病理学完全缓解(non-pCR)患者的复发风险要比病理学完全缓解(pCR)患者要高。因此,如何通过强化辅助治疗的方案帮助新辅助治疗后non-pCR的患者实现治愈目标成为临床研究的热点。
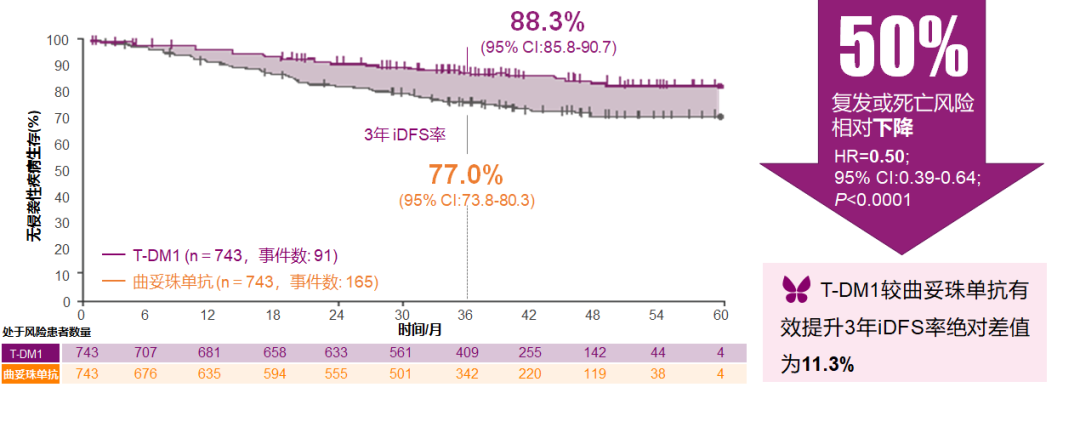
KATHERINE研究是目前唯一一项针对抗HER2新辅助治疗后仍有残存病灶的乳腺癌患者强化辅助治疗显示出生存获益的Ⅲ期研究。KATHERINE研究显示:对于non-pCR患者,中位随访41个月时,T-DM1强化辅助治疗对比曲妥珠单抗显著降低了50%的复发风险,增加了11.3%的iDFS绝对获益。基于KATHERINE研究的结果,T-DM1是目前抗HER2新辅助治疗后仍有残存病灶的乳腺癌患者强化辅助治疗的标准治疗方案。
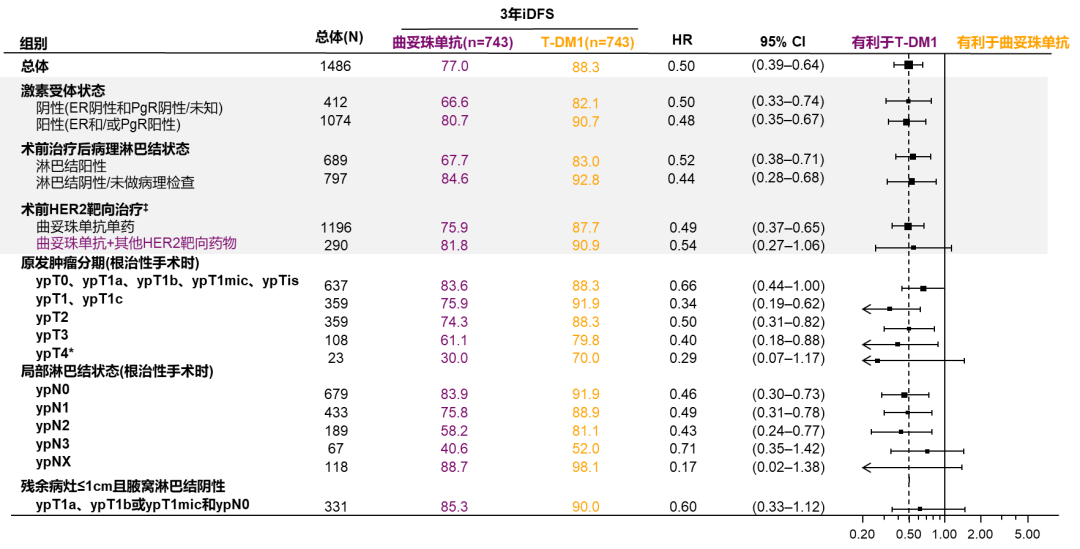
从亚组分析中我们也能看到,无论激素受体状态、淋巴结状态、采用何种新辅助抗HER2方案,T-DM1各亚组iDFS均显示获益。而对于残余病灶≤1CM且腋窝淋巴结为阴性的患者,根据研究结果仍然显示出T-DM1可以使患者获益。
因此,NCCN指南已将T-DM1作为抗HER2新辅助治疗后仍有残存病灶患者的强化辅助治疗的I类推荐方案;中国NMPA也已批准T-DM1用于接受了紫杉烷类联合曲妥珠单抗为基础的新辅助治疗后仍残存侵袭性病灶的HER2阳性早期乳腺癌患者的辅助治疗。这也是中国第一个HER2靶向ADC药物。
《肿瘤瞭望》:HER2阳性乳腺癌占全部乳腺癌分子类型的25%左右,该类型乳腺癌恶性程度高,预后差。对于HER2阳性晚期乳腺癌患者,延长患者生存,改善患者生存质量是临床的治疗目标。能否请您谈谈,HER2阳性乳腺癌晚期患者的综合诊疗策略?
孙涛教授:HER2阳性晚期乳腺癌患者预后较差,以抗HER2靶向治疗为基础的综合治疗显著延长了患者的生存期,改善了患者预后。根据CSCO指南,在抗HER2一线治疗中,TH+P(多西他赛+曲妥珠单抗+帕妥珠单抗)的双靶方案证据级别为1A。CLEOPATRA研究证实,帕妥珠单抗+曲妥珠单抗+多西他赛用于HER2阳性晚期乳腺癌一线治疗,可以显著延长PFS和OS。中位随访8年的结果显示,接受双靶向联合方案治疗,患者的中位OS达到57.1个月,而曲妥珠单抗+多西他赛组mOS则为40.8个月。目前国际上HER2阳性晚期乳腺癌标准一线治疗为帕妥珠单抗、曲妥珠单抗双靶向联合多西他赛。帕妥珠单抗已经在国内上市,这部分HER2阳性晚期乳腺癌一线可选择帕妥珠单抗联合曲妥珠单抗双靶方案。
在抗HER2的二线治疗中,T-DM1证据级别为1A。T-DM1于2013年获美国FDA批准上市,用于既往曲妥珠单抗和紫杉醇单药或联合治疗的HER2阳性转移性乳腺癌,其目前是国际上标准的抗HER2二线治疗方案,该推荐基于EMILIA研究结果:研究入组了980例既往紫杉类和曲妥珠单抗治疗进展的HER2阳性晚期乳腺癌患者,T-DM1组和拉帕替尼+卡培他滨对照组的客观缓解率分别为43.6%和30.8%,中位PFS分别为9.6个月和6.4个月,中位OS分别为30.9个月和25.1个月,均有显著差异。另外,TH3RESA Ⅲ期临床试验显示,应用曲妥珠单抗、拉帕替尼及紫杉类药物进展的晚期乳腺癌患者,T-DM1能显著改善PFS(6.2 个月 vs. 3.3 个月,P<0.0001)和OS(22.7 个月和 15.8 个月,P=0.0007)。因此,T-DM1可用于HER2阳性晚期乳腺癌二线及以上的解救治疗。
《肿瘤瞭望》:对于T-DM1这个药物,您是否有一些患者已经使用过这个药物,能否给我们分享一下用药经验?
孙涛教授:目前T-DM1在国内上市的适应人群为HER2阳性新辅助治疗后non-pCR乳腺癌患者辅助治疗方案。2015年12月,我们治疗的患者中有一例患者,在国外购买了T-DM1。该患者为我院第一例应用T-DM1治疗的晚期乳腺癌患者,所以我印象很深刻。该患者是一位辅助曲妥珠单抗后原发耐药的患者(DFS 8个月,当时是肺结节性质待定,2015年12月结节增大,并有新发双肺结节,如果按照确切诊断DFS为14个月),应用T-DM1治疗4个周期200mg后,达到PR,III°血小板减少和II°转氨酶升高,不良反应恢复之后再应用T-DM1治疗2个周期160mg后,疗效接近CR。后期患者未再应用T-DM1,也拒绝其他治疗方案,未再行抗肿瘤治疗。上次随访是19年9月30日,影像学检查显示肺结节一直是接近CR,未再出现进展并且疗效维持长达3年8个月。T-DM1在这例患者上显示出了卓越的疗效。
《肿瘤瞭望》:T-DM1已于今年1月获批,4月8日正式供货,将给HER2阳性乳腺癌患者带来的福音,如何做好患者的规范治疗以及其重要性?
孙涛教授:首先要严格按照标准治疗方案进行治疗,对于新辅助治疗实现了pCR 的患者,应该延续之前的新辅助治疗方案直至1年的抗HER2 治疗。对于新辅助治疗后non-pCR的患者,这部分患者具有很高的复发风险,应该给与强化辅助治疗策略。根据Katherine 研究,T-DM1是目前唯一的抗HER2治疗后non-pCR患者强化辅助治疗的标准方案。
其次,医生、患者未来的共同目标是要治愈乳腺癌,所以持续的疗程、标准的剂量以及毒性方面的预防和处理,也是我们需要共同努力的方向。除血小板计数降低外,其他≥3级AEs发生率均较低血小板降低并未造成临床显著性出血风险的增加大部分出血事件为轻度出血。KATHERINE研究的中国人群中,22%接受T-DM1的患者发生了3-4级血小板计数降低,所有事件均痊愈或逐渐缓解。其中1例患者发生持续性血小板减少,在使用艾曲泊帕后,逐渐缓解。目前T-DM1已经可及,我希望这个药物能够造福更多患者。
辽宁省肿瘤医院乳腺内科主任
中国医科大学博士研究生导师
辽宁省肿瘤医院临床试验机构办公室主任
辽宁省肿瘤医院乳腺疾病诊疗中心副主任
辽宁青年名医、省优秀科技工作者、省青年科技奖获得者
辽宁省政府授予“辽宁省百千万人才工程百层次人才”
中国临床肿瘤学会(CSCO)乳腺癌专业委员会常委
中国临床肿瘤学会(CSCO)肿瘤心脏病学专家委员会副主任委员
中国抗癌协会肿瘤标志物专业委员会常委
中国抗癌协会多发和不明原发肿瘤专业委员会常委
中国老年学和老年医学肿瘤康复分会副主任委员
中国研究型医院精准医学与肿瘤MDT专业委员会副主任委员
辽宁省抗癌协会肿瘤标志物专业委员会主任委员
辽宁省抗癌协会化疗专业委员会(候任)主任委员





 京公网安备 11010502033352号
京公网安备 11010502033352号