编者按:复旦大学附属肿瘤医院胰腺外科虞先濬教授领衔研究团队,通过研究发现胰腺神经内分泌肿瘤(pNET)中DNA损伤修复蛋白的表达特征,并据此建立了复发特征模型,为pNET患者术后随访和个体化辅助治疗的提供了新的决策依据。该研究论文于近日发表于被誉为“外科学圣经”的《外科年鉴》(Annals of Surgery,IF=9.47)杂志上。虞先濬教授应邀与我们分享该研究成果如下。
《肿瘤瞭望》:我们临床上对pNET的生物学特征了解有多少?有哪些临床特征或者生物标志物可用于指导pNET的术后复发和预后情况?
虞先濬教授:胰腺神经内分泌肿瘤(pNET)是一种相对罕见的疾病,发病率不及胰腺癌的1/10。苹果公司的乔布斯正是罹患pNET而将该疾病带入大众视野。以往认为pNET是类癌,恶性程度较低;但也有人认为其具有一定的侵袭和转移能力。直到2010年,我们才对pNET有了比较统一的认识,即胰腺神经内分泌肿瘤都有一定的恶性特征,恶性程度较低者生长速度较慢,恶性程度较高者甚至成为胰腺神经内分泌癌(pNEC)时,则更加凶险。由此可见,pNET的异质性较高。即便是相同区域、相同切片的肿瘤细胞,也可呈现不同的病理学和生物学特征。
肿瘤治疗在向着个体化、精准化的方向发展,前提是能够正确分辨疾病,从临床病理到分子基因层面掌握肿瘤的预后标志物和潜在的治疗靶点,也就是我们经常说的“异病同治”和“同病异治”。目前pNET最常用的生物标志物是增殖指数Ki-67,可一定程度上反映肿瘤负荷及增殖侵袭性。嗜铬蛋白家族成员CgA也曾是诊断神经内分泌肿瘤的标志物,但其敏感性和特异性较差,临床上已不再普遍应用。此外,肿瘤大小和分级、淋巴结状态、PAX6表达、CD68评分等临床病理特征对pNET术后患者的生存预后也有一定的判断作用。总之,pNET的肿瘤异质性较高,目前临床尚缺乏有效的标志物用于预后和治疗指导。
《肿瘤瞭望》:在您所领导的这项研究中,利用DDR蛋白的表达水平对pNET术后患者复发生存进行预测。这项研究取得什么样的结果,有什么样的临床意义?
虞先濬教授:手术仍是目前临床上可切除pNET的主要治疗方式。病理确诊为pNEC或者Ki-67>20%、G3(高增殖活性)的pNET等患者术后需要进行辅助治疗。但对于Ki-67<20%、G1/G2等所谓中低危患者,仍没有准确的指标可以筛选出需要进行辅助治疗的患者,但临床中确实存在部分患者术后复发的情况。因此,我们的研究就是要针对这些惰性的pNET,寻找能够用于指导预后判断和治疗的生物标志物。
我们的研究通过检测pNET组织芯片并结合预后生存资料发现,在12个DNA损伤修复相关蛋白中,有2个(ATM和CHK2)具有预测复发的价值。进一步结合临床病理资料分析发现了其不同的复发特征,并构建了复发特征模型。该模型结合肿瘤大小、淋巴结状态以及ATM和CHK2的表达情况将术后患者分为复发低危人群、中危人群和高危人群三类,有利于更精细的随访术后患者,比如复发低危患者可1年随访1次,中危患者可半年随访1次,而高危患者需每3个月随访1次。同时,针对不同的复发危险程度可个体化给予辅助治疗。对于某些有DNA损伤修复蛋白表达缺陷的患者甚至可给予针对性的靶向药物治疗。
《肿瘤瞭望》:我们知道DDR在乳腺癌、前列腺癌、卵巢癌等瘤肿中的研究比较多,并且PARP抑制剂也有比较好的疗效。请您简单介绍一下pNET的药物治疗现状?
虞先濬教授:近年来,pNET的药物治疗研究进展比较快,目前临床上主要用于转移性pNET和部分术后高复发风险患者。首先,pNET具备内分泌性,可以选择生长抑素类似物(SSA)治疗,SSA比较温和,是神经内分泌瘤的基础药物治疗。其次是靶向治疗,多靶点TKI舒尼替尼、mTOR抑制剂依维莫司的疗效和耐受性均较好,均已证实可改善患者无进展生存。第三是化疗,pNET与胰腺癌的化疗方案不太一样,比如G3级NET辅助化疗常用卡替方案(卡培他滨+替莫唑胺),G3级NEC则选择经典的含铂EP方案(依托泊苷+顺铂)。
当然,还有很多新的潜在治疗靶点药物正在临床研究中。DNA重组修复缺陷(HRD)在恶性肿瘤中还是很常见的。PARP抑制剂是利用“合成致死”概念的靶向药物,已经被证明在携带BRCA、ATM等HRD基因的卵巢癌、前列腺癌患者具有很好的疗效。我们的这项研究也表明,pNET具有一定的DNA损伤修复蛋白表达缺陷的特征,对于是否也适用PARP抑制剂进行治疗,需要进一步的体外及活体实验进行验证。
《肿瘤瞭望》:您在论文中也提到了这项研究的一点局限性,比如没有用G68 PET-CT进行影像学检测,毕竟PET-CT的可及性仍有限,是否有其他pNET术后监测的补充手段?这项研究下一步是否还有其他临床转化研究?
虞先濬教授:当然,G68 PET-CT用于术后监测的敏感性更好。比如一般的(18F-FDG)PET-CT能检查出2个复发转移灶,而用G68 PET-CT就可能检查出10个。遗憾的是,研究进行之初受条件所限,我们无法应用G68 PET-CT影像检查。但我们也通过生化标记物、CT或MRI等可及的手段进行术后随访,对可疑复发者积极组织多学科会诊,并采用来监测患者在根治性切除术后的随访期;当怀疑复发时,则组织多学科会诊并使用99mTc-HYNIC-TOC生长抑素受体闪烁显像、(18F-FDG)PET-CT、超声造影等多种成像技术进行辅助诊断。
对于下一步的工作,我们希望能够将这项研究中证实的、具有预后指导价值的ATM、CHK2蛋白,开发出相应的试剂盒用于临床常态化的病理检测,以便后续进行前瞻性的或者真实世界的研究。另外,对于ATM阳性,术后6个月复发的患者,后续还要探索其治疗药物与用药时间,比如化疗药物、靶向药物、亦或生长抑素,哪个效果会更好。我们将一步一个脚印的面对并处理每一个问题。
DNA损伤修复(DDR)蛋白在胰腺导管腺癌等多个瘤肿中有重要作用,但在胰腺神经内分泌瘤(pNET)中的表达模式和预后价值尚不清楚。为了探讨DDR蛋白在已切除pNET中的表达谱及其预测价值,本研究回顾性分析2012年至2018年间在复旦大学肿瘤医院接受切除术的pNET患者资料,对组织芯片中12种DDR蛋白进行免疫组化染色。应用Cox回归模型和随机生存森林模型研究DDR蛋白表达、临床病理特征与无复发生存(RFS)的关系。
研究共纳入131例pNET患者,其中复发32例(24.4%)。在12种DDR蛋白中,低检查点激酶2(CHK2)表达(P=0.020)和共济失调毛细血管扩张突变(ATM)缺失(P=0.0007)与复发显著相关。多变量Cox回归分析显示肿瘤≥3cm、淋巴结转移、肿瘤分级高、CHK2低表达、ATM缺失是复发的独立危险因素。根据复发特异性危险因素的建立复发特征,特征为淋巴结阴性且肿瘤<3cm(LNnegTumorSize<3cm)的患者5年RFS率达96.8%,而淋巴结阳性且CHK2低表达(LNposCHK2low)的患者5年RFS率(0%)最差。判别(一致性指数:0.770)和校正图表明,该研究所建立的复发特征具有很好的识别复发风险患者的能力。
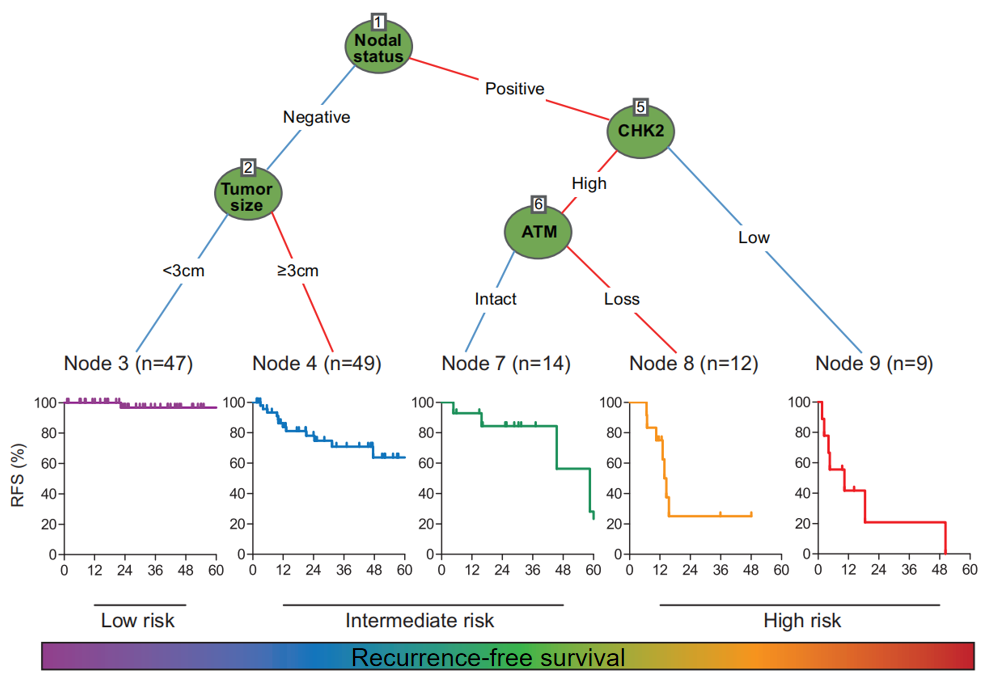
该研究通过分析pNET的组织芯片,评估了12个DDR蛋白表达谱,并结合临床病理特征构建了一个新的复发特征模型,可用于判断pNET患者术后RFS情况,有助于完善个体随访。
复旦大学附属肿瘤医院胰腺外科及胰腺肿瘤综合治疗部是目前亚洲最大的胰腺肿瘤治疗基地。虞先濬教授提出 “临床为本,科研为魂,胰路前行,勇攀高峰”的发展目标,致力于医教研齐头并进,先后创建了复旦大学胰腺肿瘤研究所,上海市胰腺肿瘤研究所,胰腺肿瘤综合治疗部。
在团队建设上,从建科之初的3-4位医生7张床,发展到现在四个大组,近百人的团队,近150张床。每个大组都由主任、教授、主治、住院、研究生、护理组、专职科研、行政科研护士组成复合型立体团队组合;在临床上,胰腺手术量逐年稳步增长,连续六年胰腺恶性肿瘤年手术量名列上海第一, 同时完成综合治疗10000余人次;2019年全年胰腺微创手术比例已达到近50%;他们不断进行手术技术创新、手术策略创新,进行了临床科研转化,改写国际指南,提出了“上海方案”,执笔中国指南。整个团队每年承担大量科研任务,发表50余篇国内外论文,同时又培养了大批研究生和后备人才。






 京公网安备 11010502033352号
京公网安备 11010502033352号